
Noch mehr Infos zum Wasser
Wie, wo, was zum Wasser
Chemie,
Tripelpunkt, Struktur,
Geheimnisse, einfach
anders, Wasser und Kälte,
Schmelzenthapie, Fliessgeschwindigkeit,
Dissoziation, Elektrolyse,
Mensch und Wasser, Kältetoleranz,
Wasserfrei, Erde
und Wasser, Chlor im Wasser,
Reinigung von Wasser,
Ökosysteme, Wasserrecht,
Analytik des Wassers, Verwendung
des Wassers, Kurze Geschichte
des Wassers, Literatur
zum Wasser, Diagramme,
Oberflächenspannung,
Grenzflaechenspannung,
Enthärtung,
Ionenaustauscher,
Entcarbonosierung,
Vollentsalzung, Trinkwasser,
Saure-Regen-Theorie
ist nicht korrekt!
Wie, wo, was zu den Tensiden
Aufbau der Tenside , Seltsames Verhalten der Tenside, Historisches zu Tensiden, 2500 v.Chr., Tenside im 17. Jahrhundert, Tenside im 20. Jahrhundert, Reinigung mit Tensiden, Einteilung der Tenside, Produktion von Tensiden , Tensidproduktion, Chlor im Wasser, Reinigung von Wasser, Ökosysteme, Oberflächenspannung, Grenzflaechenspannung
Einige chemische und physikalische Eigenschaften von Wasser, Kurzfassung
Wasser (Wasserstoffoxid). H2O, MG. 18,02. In reinstem Zustand ist Wasser eine klare, geruch- und geschmacklose, farblose – in dicker Schicht jedoch ebenso wie Eis bläulich schimmernde – Flüssigkeit,
Schmelzpunkt. 0°=273,15 K,
Sdp. 100°=373,15 K; durch den Schmelzpunkt (Gefrier-oderErstarrungspunkt)
und Siedepunkt des Wasser bei 1013 mbar ist die Celsius-Temperatur-Skale
festgelegt.
1 cm3 Wasser von 4° besitzt die Masse von 1 g;
Eis von 0° hat die Dichte 0,9168.
Das (berechnete) Litergewicht des Wasserdampfes beträgt unter Normalbedingungen
(0° und 1013 mbar) 0,5974 g;
seine Dichte ist 0,462 (wenn Luft von 0°=1 gesetzt wird),
seine kritisch Temp. 374°,
der kritisch Druck 221,29 bar,
die kritisch Dichte 0,315,
das kritisch Molvol. 0,057 l/mol.
Beim Tripelpunkt des Wasser liegen flüssiges Wasser, Eis und Wasserdampf im nonvarianten Gleichgewicht nebeneinander vor; als zugehörige Temp. ist 273,16 K=0,01° definiert worden – der „wahre“ Tripelpunkt liegt bei 0,0099° und 611 Pa (6,11 mbar).
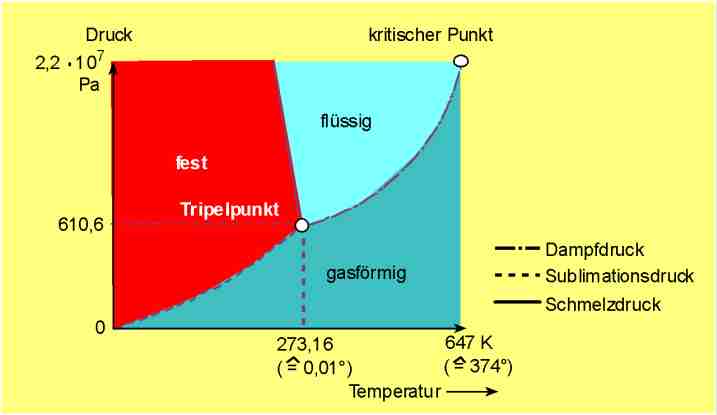
Abb. 1: Zustandsdiagramm von Wasser.
Die Abb. zeigt vereinfacht das Zustandsdiagramm von Wasser. Da es mehrere
Eis-Modif. gibt (s. unten), sind zahlreiche weitere Tripelpunkte bekannt,
z.B. zwischen flüssigem Wasser und zwei festen Eis-Phasen und zwischen
drei Eis-Modifikationen. Die molaren kryoskop. bzw. ebullioskop. Konstanten
betragen 1,86° bzw. 0,51° (s. Molmassenbestimmung). Weitere Daten des
Wasser (im allg. bei 25° und 1013 mbar): Spezif. Wärmekapazität
4,1855 J/g·K (die zur Erwärmung von 1 g H2O von 14,5 auf 15,5° erforderliche
Wärmemenge wurde früher als die Wärmeeinheit Grammcalorie
bezeichnet, 1 cal=4,1868 J.), Bildungsenthalpie 285,89 kJ/mol, Schmelzenthalpie
6,010 kJ/mol (bei 0°), Verdampfungsenthalpie 40,651 kJ/mol (bei 100°),
Oberflächenspannung 71,96·10–3 N/m, Viskosität 0,8937 mPa·s.
Die elektr. Leitfähigkeit 0,0635 mS/cm ist ein Maß für
die Reinheit des Wasser; schon geringe Zusätze verändern die
Leitfähigkeit erheblich. Die sehr große Dielektrizitätskonstante
(e=80,18) ist fast die höchste unter den Flüssigkeiten. Weitere
Daten findet man – z.T. auch in Abhängigkeit von der Temp. aufgeführt
– z.B. in Literatur 1, 2, sowie in vielen Beiträgen
des J. Phys. Chem. Ref. Data.
Struktur und Bindungsarten von Wasser
Abb. 2: Struktur (a.) und Molekülorbital (b.) von Wasser.
Einige der physik. Eigenschaften von Wasser und Eis gaben Anlaß
zu interessanten Experimenten, 3. Die in mancher
Hinsicht anomalen Eigenschaften des Wassers lassen sich auf die Struktur
des H2O-Moleküle zurückführen, in dem die beiden
Wasserstoff-Atome unter einem Winkel von 105° angeordnet sind (Abb. 2a).
Aufgrund der unterschiedlichen Elektronegativitäten von Sauerstoff
(3,44) und Wasserstoff (2,20) ist die O–H-Bindung polarisiert, Dichteh.
die beiden entgegengesetzten elektr. Pole fallen in ihrer räumlichen
Lage nicht zus., so daß das Wasser-Moleküle einen Dipol bildet.
In der Elektronendichteverteilung überlappen sich die p-Orbitale
des Sauerstoff-Atoms mit den s-Orbitalen der Wasserstoff-Atome zu s-Bindungen,
etwa wie die Darst. des Molekülorbitals (Abb. 2b) zeigt:
Das aus der Polarisation resultierende Dipolmoment wurde zu m=1,85 Debye bestimmt, und die Differenz der Elektronegativitätswerte erteilt – nach Pauling – der ansonsten kovalenten Bindung einen partiellen Ionen-Charakter. Diese und die dielektr. Eigenschaften erklären die Eignung des Wasser als Lsgm. für polare Stoffe, die elektrolytische Dissoziation gelöster Salze, Basen und Säuren, die Neigung zur Komplex-Bldg. (Aquotisierung und H2O-Austausch, vgl. Koordinationslehre), die Solvatation (Hydratation; die Bldg. von Hydraten kann mit Erwärmung oderAbkühlung verbunden sein), die Fähigkeit zur Ausbldg. von Wasserstoff-Brückenbindungen und damit v.a. auch die Struktur des flüssigen Wassers. In diesem herrscht nämlich ein bestimmter Ordnungszustand, dessen Zustandekommen die Chemiker seit langem interessiert.
Geheimnisse des Wassers
Auch heute sind noch nicht alle Fragen zur Struktur
des Wasser beantwortet. Aus quantenmechan. Berechnungen und den Ergebnissen
von Unters. mittels Röntgen- und Neutronenbeugung, IR- und Raman-Spektroskopie
wurden die beiden Kontinuum- und Mischungsmodelle für die Wasser-Struktur
abgeleitet. Letzteres, das man auch Cluster-Modell (vgl. Cluster-Verbindungen)
nennt, nimmt an, daß durch Wasserstoff-Brückenbindungen zusammengehaltene
Aggregate einer dem Eis I analogen Struktur einzelne ungebundene Wasser-Moleküle
auf Zwischengitterplätzen enthalten. Näheres zur Wasser-Struktur
s. Literatur, 4.
Eine laseropt. Meth. zur direkten photograph. Abb. der hexagonalen Oberflächenstruktur
des Wasser beschreibt Literatur, 5.
Manche Verb. (chaotrope Stoffe) können, in Wasser gelöst, dessen
Ordnungszustand herabsetzen, indem sie die H-Brücken zerstören.
Wasser ist anders als die Anderen, vor allem das Dichteverhalten
Eine Reihe von Eigenschaften heben das Wasser aus der Gruppe der Wasserstoff-Verb. der dem Sauerstoff benachbarten Elemente heraus: Während alle Wasserstoff-Verb. der Nichtmetalle Gase sind, ist Wasser als einzige flüssig (hypothet. Schmelzpunkt. –100°, Sdp. –80°); während viele dieser „Hydride“ tox. sind, ist Wasser der Hauptbestandteil der Körperflüssigkeit aller Organismen; während sich fast alle Flüssigkeiten beim Gefrieren zusammenziehen und sich dadurch ihre Dichte erhöht, dehnt sich Wasser beim Erstarren aus. Das Dichte-Maximum (Vol.-Minimum) des Wasser liegt bei 4°. Diese Eigenschaften bewirkt nicht nur, daß Eis auf flüssigem Wasser schwimmt, daß es Eisberge gibt (von denen aufgrund der Dichte-Differenz zwischen Eis und Meerwasser nur 12% sichtbar sind) und daß – zus. mit der geringen Wärmeleitfähigkeit des Eises – Gewässer von der Oberfläche her, nicht aber bis zum Grund gefrieren (Überlebenschance für Organismen), sondern auch, daß gefrierende Wasserleitungen usw. platzen und Gesteine mit Wasser-Einschlüssen gesprengt werden können, s. Verwitterung. Eine weitere Anomalie zeigt Wasser in der Druckabhängigkeit des Schmelzpunkt.: Unter einem Druck von 2000 bar erstarrt Wasser erst bei –22°, während bei anderen Flüssigkeiten der Schmelzpunkt unter Druckeinwirkung im allg. zunimmt. Erst bei 6,2 kbar schmilzt Wasser wieder bei 0°, und bei ca. 32 kbar ist der Schmelzpunkt. 100°.
Seltsames Verhalten von Wasser bei Kälte
Reinstes Wasser läßt sich durch Unterkühlung bis ca. –20° flüssig halten, als Tropfen in org. Lsgm. sogar bis ca. –40° und unter Druckeinwirkung von 2000 bar noch bei –90°. Mit den physik. Eigenschaften von unterkühltem Wasser beschäftigt sich Literatur, 6. Man kennt mindestens 13 unterscheidbare Eis-Modif.; Eis I („normales“ Eis) krist. hexagonal, und die Sauerstoff-Atome sind tetraedr. nach Art des b-Tridymit-Gitters angeordnet. Näheres insbes. zu den Hochdruck- und Tieftemp.-Modif. Eis VI–VIII s. Literatur 7. Festes Wasser konnte auch im Glaszustand hergestellt werden, 8. Im Wasserdampf sollen z.T. Dimere (H2O)2 vorliegen. Im überkritisch Zustand (s. überkritische Flüssigkeiten bzw. Gase) löst Wasser manche normalerweise wasserunlösl. Stoffe; dies kann zu Extraktionszwecken genutzt werden, und könnte auch die Entstehung einiger Lagerstätten erklären (Pneumatolyse, Hydrothermalsynthese). Zeitweilig erregte sog. Polywasser (auch als Wasser II, anomales Wasser, SuperwasseroderDerjagin-Wasser bezeichnet) Interesse, eine allerdings nicht reproduzierbare „Wasser-Modif.“ mit seltsamen Eigenschaften, deren Existenz letzten Endes nicht bewiesen werden konnte, 9. Auch magnetisiertes Wasser erregte zeitweilig Verwirrung, 10.
Schmelzenthalpie von Wasser
Zu den Anomalien des Wasser zählt weiterhin die große Erstarrungs-(Schmelz)-enthalpie, die wesentlich über derjenigen anderer niedrigschmelzender Verb. liegt; diese Eigenschaften ist für das klimat. Geschehen im Winter, für die Eis-Bldg. in Wolken usw. von Bedeutung. Über den Werten vergleichbarer Verb. liegen beim Wasser auch die Werte von Verdampfungsenthalpie, Oberflächenspannung, spezif. Wärmekapazität, Schallabsorption und Viskosität.
Fließeigenschaften von Wasser
Die Fließeigenschaften des Wasser, z.B. für Löschwasser, lassen sich durch Zusatz sog. Widerstandsverminderer (WV) von der Art des Polyethylenoxids verbessern. Wasser ist mischbar mit den niederen Alkoholen, Glykolen, cycl. Ethern, Aminen, Carbonsäuren und Aceton, in den höheren Homologen nimmt die Löslichkeit mit steigender C-Zahl ab, und in unpolaren Flüssigkeiten wie Kohlenwasserstoffen und Halogenkohlenwasserstoffen ist es prakt. unlösl., desgleichen in aliphat. Ethern und Estern.
Dissoziation des Wassers
Bei Raumtemp. ist Wasser kaum dissoziiert (s. elektrolytische Dissoziation und pH): Die Dissoziationskonstante bei 25° beträgt Kw=10–14 (pKw=14), Dichteh. in 10000 t Wasser ist nur 1 Mol Wasser (18 g) in ca. 1 g Protonen (H+ bzw. [H3O]+) und ca. 17 g Hydroxid-Ionen (OH–) zerfallen; Näheres s. bei pH, pK-Wert und Ionenprodukt. Nach Brønsted (s. Säure-Base-Begriff) darf Wasser als amphoter, Dichteh. als äußerst schwache Säure und als äußerst schwache Base zugleich gelten. Durch Elektrolyse läßt sich Wasser in seine Bestandteile zerlegen, wobei sich an der Kathode Wasserstoff und an der Anode Sauerstoff im Vol.-Verhältnis 2:1 abscheiden; zur Verbesserung der elektrischen Leitfähigkeit setzt man Elektrolyte hinzund
Wasser-Elektrolyse
Der Prozeß der Wasser-Elektrolyse wird techn. zur Gewinnung von Wasserstoff (und Sauerstoff) benutzt. Photochemischen läßt sich Wasser zwar nicht durch sichtbares Licht, aber durch sehr kurzwellige Ultraviolettstrahlung in H2 und O2 spalten. Auf dem Umweg über Sensibilisatoren wie Chlorophyll ist die Photolyse von Wasser jedoch zus. mit der CO2-Red. die bei weitem umsatzstärkste chemischen Reaktion auf Erden, nämlich als PhotosyntheseoderAssimilation, 11. . Verständlicherweise sind viele Prozesse für die Wasser-Zers. nach dem Modell der Photosynth. entwickelt worden; die dort und bei Photolyse zitierten Autoren benutzen die im allg. Ruthenium-org. Verb.oderTitandioxid als Katalysator. Bei der Radiolyse des Wasser entstehen v.a. H-Atome, OH-Radikale und solvatisierte (hydratisierte) Elektronen (vgl. Strahlenchemie). Zur direkten therm. Zers. des Wasser nach 2H2O==>2H2+O2 (der Umkehrung der Bildungsreaktion in der Knallgas-Reaktion) müssen erhebliche Energiebeträge (mindestens 238 kJ/mol) aufgewendet werden – bei ca. 2000 K ist erst etwa 1% der Wasser-Moleküle in H2 und O2 zerfallen. Auch hier gelingt es auf Umwegen, die zur thermochemischen Zers. notwendigen Bedingungen zu verbessern, wobei man ausnutzt, daß Wasser trotz seiner großen Stabilität vielfältige chemischen Reaktionen einzugehen vermag. Hauptreaktionstypen sind: Sauerstoff-Entwicklung bei der Einwirkung von Oxid.-Mitteln (z.B. H2O+Cl2==>2HCl+O), Wasserstoff-Entwicklung bei der Einwirkung von ReDichte-Mitteln (z.B. Fe+H2O==>FeO+H2, vgl. Rost und Rosten), Hydrolyse. Bei hohen Temp. kann Wasser viele Elemente direkt oxidieren (z.B. C==>CO+H2 bei der Kohlevergasung), mit Oxiden bildet es HydroxideoderSäuren [z.B. CaO==>Ca(OH)2oderSO3==>H2SO4oderP2O5==>H3PO4 usw].
Nachweis und Reaktionen des Wassers
Kleine Wasser-Mengen können viele Reaktionen katalyt. beeinflussen, insbes. Kettenreaktionen. Einige der chemischen Reaktionen von typ. Trockenmitteln mit Wasser sind auch zur Entfernung desselben z.B. aus org. Lsgm. geeignet, vgl. Trocknen. Nachw: Zum qual. Nachw. und zur (halb)quant. Best. von Wasser in Form von Feuchtigkeit eignen sich wasserfreie Verb., die mit Wasser unter Farbänderung reagieren: Farbloses, mit K[PbI3] getränktes Papier wird gelb (Bldg. von PbI2), hellblaues CoCl2 bzw. grünes CoBr2 werden rot (Bldg. von Hydraten), farbloses CuSO4 wird blau (Hydrat-Bldg.); Propyltitanat, Magnesium- und Aluminiumalkoholate trüben sich in GgWasser von Wasser. Andere Stoffe entwickeln mit Wasser Gase, deren volumetr. Best. zur Wasser-Analyse genutzt wird: Calciumhydrid entwickelt Wasserstoff, Calciumcarbid Acetylen, Magnesiumnitrid Ammoniak, Triethylboran Ethan. Mit Prüfröhrchen läßt sich Wasser-Dampf im Bereich von 0,1–40 mg/l Luft bestimmen. Das wohl geläufigste chemischen Verfahren zur Wasser-Best. (Aquametrie) ist die Titration mit dem Karl-Fischer-Reagenz, s. dort und Literatur, 12. Häufig läßt sich auch die Gaschromatographie einsetzen. Daneben existieren viele, z.T. automatisierte, physik. Best.-Meth., in denen man die Infrarotabsorption oder-reflexion des Wasser, NMR-spektroskop., elektrolyt., dielektr. Meth. zur Feuchtigkeitsbest. heranziehtodermit Wägung nach Zwischentrocknung arbeitet. Ferner gibt es speziell zur Wasser-Best. entwickelte Geräte wie Hygrometer – insbes. Taupunkt-Hygrometer – und Psychrometer. Physiolog.: Für die Organismen ist Wasser unentbehrlich: Als Lösungs-, Transport- und Quellungsmittel ermöglicht Wasser die zahlreichen chemischen und kolloidchemischen Zellreaktionen.
Mensch und Wasser
Der durchschnittliche Wasser-Gehalt des erwachsenen Menschen beträgt über 50%. Der tägliche Wasser-Umsatz beläuft sich auf etwa 2,5 l: Als Trinkflüssigkeit werden ca. 1200 ml, mit dem Wasser-Gehalt der Nahrungsmittel ca. 1000 ml aufgenommen (zur Steuerung der Wasser-Aufnahme s. Literatur, 13), und als Oxid.-Pro. des Stoffwechsels entstehen ca. 300 ml; ausgeschieden werden als Harn ca. 1500 ml, als Schweiß 600 ml, durch die Atemluft 300 ml und im Kot 100 ml. Die Regulation des mit dem Elektrolyt-Haushalt gekoppelten Wasser-Haushalts erfolgt durch das RAA-Syst. (s. Renin), Vasopressin, Mineralcorticoide (s. Corticosteroide und Nebennierenhormone) u.a. die Tätigkeit der Nieren beeinflussende Hormone. Das Wasser regelt auch die Körpertemp., indem es durch Verdunsten an der Hautoberfläche Wärme entzieht (s. Schweiß). Größere Wasser-Verluste können bei starkem Fieber, Diarrhoe, Erbrechen, Ödemen und Verbrennungen auftreten.
Kältetolerante Organismen
Kältetolerante Organismen (Literatur, 14 ) verhindern die Eis-Bldg. mit Hilfe körpereigener Gefrierschutzmittel, z.B. mit Glykoproteinen (bei arkt. Fischen)odermit Glycerin, Sorbit, Glucose und Prolin (bei Gallenfliegenlarven). Eine andere Taktik verfolgen Mikroorganismen, die mit Proteinen als Gefrierkeimen die extrazelluläre Eis-Bldg. fördern. Da die Aktivität von Enzymen an die GgWasser von Wasser gebunden ist, lassen sich Enzym-haltige Nahrungsmittel durch Trocknen – am schonendsten durch Gefriertrocknung – dauerhaft konservieren.
Wasserfreie Lebensformen
Andererseits sind manche Organismen in der Lage, durch Bldg. von Dauerformen (Sporen, Samen) wasserarme oder gar wasserfreie Perioden zu überstehen (Anhydrobiose, s. Literatur, 15). Für standortgebundene Pflanzen ist Wasser von bes. Bedeutung. Bes. Arten wie Sukkulenten haben sich einem evtl. Wasser-Mangel angepaßt, z.B. durch dichte Behaarung, Verminderung der wasserverdunstenden Oberfläche (Kakteen, trop. Euphorbien), Versenkung der Spaltöffnungen, Verstärkung der Kutikula, Erhöhung der Salzkonz. und des osmot. Drucks in den Wurzeln usw. Im Gegensatz zum Wasser ist das Erdreich für die Pflanzen entbehrlich (s. Hydrokultur).
Und Andere
Frische, grüne Wiesenpflanzen bestehen zu 70–80% ihres GeWasser aus Wasser, Wassermelonen zu 93%, Gurken zu 96%, Kürbisse, Rhabarber und Kopfsalat jeweils zu 95%. Eine Sonnenblume dunstet an einem klaren, sonnigen Tag etwa 1 l Wasser ab, eine Birke mit 200000 Blättern 60–70 l, ein Hektar Buchenwald mit 400 Bäumen im Lauf einer Vegetationsperiode etwa 3,6 Mio. l Wasser; das wären etwa 60% der Niederschläge, wenn man eine Niederschlagsmenge von 600 mm zugrunde legt. Bei künstlicher Bewässerung benötigt man 500 t Wasser, um 1 t Getreide zu ernten. Vork.: Obwohl ca. 71% der Erdoberfläche von Wasser bedeckt sind, ist der Anteil von Wasser an der obersten, 16 km dicken Erdkruste nicht bes. hoch; der Anteil des Wasserstoffs wird in diesem Bereich nur auf etwa 1% geschätzt. Der gesamte Wasser-Vorrat in den Meeren, Seen, Flüssen, Sümpfen, Grundwässern, in Gesteinen adsorbiertes Wasser, und in der Lufthülle wird auf 1,4·1018 t geschätzt; dazu sind etwa 0,257·1018 t in den Gesteinen chemischen gebunden. Zur Verteilung der Gesamtmenge von Wasser (etwa 1,4·1018 m3) s. Tab. 2. Der atmosphär. Wasser-Dampf wird durch das UV der Sonnenstrahlen langsam in Wasserstoff (entweicht in den Weltraum) und Sauerstoff (wird z.T. in geolog. Oxid.-Prozessen gebunden) zerlegt. Eis und Wasser-Dampf sind auch im interstellaren Raum bzw. in der Mars- und Venus-Atmosphäre nachweisbar, flüssiges Wasser gibt es nur auf der Erde; hierzu s. Literatur, 17.
Erde und Wasser
Natürliches Wasser besteht zwar im wesentlichen aus H216O, doch kommen auch – nach Maßgabe des natürlichen geochemischen Gehalts an Deuterium und Tritium und den Sauerstoff-Isotopen – Moleküle wie H218O, D216O, D218O, H216O, H217O usw. vor; Schweres Wasser (Deuteriumoxid) ist in gewöhnlichem Wasser zu etwa 0,02% enthalten; s.a. Literatur, 18. Für die Wasser-Versorgung des Menschen (Haushalt, Industrie und Landwirtschaft) stehen als Süßwasser nur die Vorräte in Seen, Flüssenoderim Grundwasser zur Verfügung. Im Gegensatz zu anderen, v.a. mineral. Rohstoffen verringert sich dieser Vorrat wegen des Wasser-Kreislaufs nur unwesentlich: Etwa ebensoviel, wie dem Wasser-Reservoir der Erde entnommen wird, fließt ihm nach Verdunstung (s. Verdampfung) als Niederschlagswasser (Wolken, Nebel, Regen, Hagel, Reif, Tau, Schnee) wieder zund Zur Unters. des Wasser-Kreislaufs und von Grundwasser-Wanderungen eignen sich Isotope. Das aus dem Kreislauf stammende Wasser wird gelegentlich vadoses, das aus tiefen Quellen erstmals zutage tretende juveniles Wasser genannt. Die Wasser-Bilanz der BRD wird regulät in Form eines sog. Sankey-Diagramms angegeben, 19. Dabei entspricht 1 mm Niederschlag 1 l/m2. Ähnliche und z.T. abweichende Darst.oderallg. Angaben zur Wasser-Bilanz der Erde findet man bei Literatur, 20. Als Wissenschaften befassen sich die Hydrologie mit den Gewässern allg. und Potamologie und Limnologie bes. mit den Binnengewässern (Flüssen und Seen). Gewinnung: H2O entsteht bei der Verbrennung von fossilen Brennstoffen, Motorkraftstoffen, Raketentreibstoffen usw., sofern diese Wasserstoff enthalten, bei der Knallgas-Reaktion, beim autogenen Schweißen, ferner bei vielen chemischen Reaktionen; Beisp.: Veresterung, Neutralisation, Oxid. und Red., Kondensation, Dehydratisierung.
Natürliches Wasser, Regen- und Schnee-Wasser Meerwasser und Brackwasser, Sicherheitschlorung ?
Außer in bes. Fällen (z.B. in der Raumfahrt) greift man bei der Gewinnung von Trink- und Brauchwasser auf die natürlichen Wasser-Vorräte zurück. Natürliches Wasser, selbst Regen- und Schnee-Wasser, ist jedoch keinesfalls chemischen rein, sondern enthält gelöste und suspendierte org. und anorg. Stoffe. Bei Mineralwässern (Tafelwässer) und solchen Quellwässern, die direkt als Trinkwasser brauchbar sind, ist ein Gehalt an mineral. Bestandteilen aus gesundheitlichen und geschmacklichen Gründen erwünscht, nicht jedoch die Anwesenheit org. Substanzen, insbes. solcher anthropogener Herkunft. Unter dem Begriff Wasseraufbereitung faßt man die Maßnahmen zur Gewinnung von Trinkwasser und von Brauchwasser für industrielle und landwirtschaftliche Zwecke zus., Dichteh. von Wasser für chemischen Reaktionen, als Lsgm., als Kesselspeisewasser zur Dampferzeugung und Heizung, zur Kühlung und Klimatechnik, zur Bewässerung usw. Als Vorräte kommen – vgl. das Sankey-Diagramm – Grundwasser und Oberflächenwasser, v. a. Fluß- und Talsperrenwasser, seltener Quellwasser in Frage, sowie unter bes. regionalen, klimat. und ökonom. Gesichtspunkten auch Meerwasser und Brackwasser. Wie geht da mit der Rohr - Verkalkung?
Reinigung von Wasser
Die Wahl der einzelnen Verfahrensschritte richtet sich sowohl nach der Verwendung als auch nach der Beschaffenheit des zu reinigenden Wassers, 21. Bei reinem Quellwasser u.U. nur eine „Sicherheitschlorung“ vorgenommen werden. Dagegen sind, um brauchbares Trinkwasser aus stark verunreinigtem Rohwasser, z.B. Uferfiltrat aus Rhein und Ruhr, zu erhalten, mehrere Reinigungsschritte erforderlich, wie Durchbruchschlorung oder Ozonisierung zur Abtötung pathogener Keime (s. Entkeimung), Flockung, z.B. mittels Eisen-oderAluminiumsalzen, und Sedimentation zur Entfernung anorg. und org. Kolloide, Filtration über Sandfilter, Entfernung gelöster anorg. Verunreinigungen, insbes. der Härtebildner (s. Härte des Wassers) durch chemischen Verfahren und org. Verunreinigungen v.a. durch Aktivkohle-Behandlung. Schließlich dient die Sicherheitschlorung zur Verhinderung einer Reinfektion des aufbereiteten Wassers im Verteilungssyst. (s. Trinkwasser). Zur Herst. von ionenarmen bzw. ionenfreiem Wasser verwendet man Ionenaustauscher; durch stufenweise Behandlung über Kationen- und Anionen-Austauscher ist Wasser mit weniger als 0,02 mg Salz/l erhältlich. Die Herst. von Reinstwasser wird in Literatur, 22 beschrieben. Zu den Qualitätsanforderungen an hoch-oderultrareines Wasser (Leitfähigkeitswasser) s. Literatur, 23; hier findet man auch Angaben über Eigenschaften und Reinheitskriterien von destilliertem, bidest., demineralisiertem und Pyrogen-freiem Wasser (Aqua). Im Deutschen Arzneibuch wird zwischen gereinigtem Wasser und Wasser für Injektionszwecke unterschieden, 24. Die Gewinnung von Trinkwasser und auch Bewässerungswasser aus Meerwasser erfolgt vorwiegend durch vielstufige (Vakuum-)Entspannungsverdampfung (MSF, E multistage flash evaporation, s. Meerwasserentsalzung). Energet. günstiger ist die umgekehrte Osmose (RO, E reverse osmosis), bei der MeerwasseroderBrackwasser unter Anw. eines äußeren Druckes durch eine semipermeable Membran (z.B. aus Polyamid) hindurchtritt und dabei in salzarmes Wasser übergeführt wird. Näheres zu den einzelnen Verfahren der Wasser-Gewinnung und -Aufbereitung findet man bei den im vorstehenden Text genannten Einzelstichwörtern. Aufwendigere Verfahren sind beim Einsatz von Flußwasser nötig, das durch unzureichend oderüberhaupt nicht gereinigte Abwässer nicht nur mineral., sondern auch org. Verunreinigungen enthält; Beisp.: Sulfate, Phosphate aus Haushalt und Landwirtschaft, Nitrate u.a. Stickstoff-Verb., Schwermetalle, Tenside, Huminsäuren und Stoffwechselpro. aus biol. Kläranlagen. Zunehmend gibt es auch Probleme mit der Qualität des Grundwassers, das durch Auswaschungen aus Deponien (s. Altlasten), Straßenverkehr und Landwirtschaft belastet ist; zur Grundwassersituation s. Literatur, 25.
Ökosysteme Flußwasser und Grundwasser
Wenn auch die Ökosysteme Flußwasser und Grundwasser über Mechanismen der Selbstreinigung verfügen und die Mikroorganismen in der Lage sind, Mineralöl- und Tensid-Rückstände durch biologischen Abbau großenteils unschädlich zu machen, so sind doch viele Schadstoffe persistent und können über die natürliche Nahrungskette ggf. sogar angereichert werden; Beisp.: PCB und Pestizide. Die Reinhaltung des Wasser zählt zu den Aufgaben des Natur- und Umweltschutzes sowie der Wasserwirtschaft. Hierbei handelt es sich um den Gewässerschutz (s. dort) sowie um die Reinhaltung des in Wasser-Versorgungsanlagen befindlichen Wasser, Beisp.: Schutz von Brunnen, Behältern usw. vor Verunreinigungen, Verwendung geeigneter Werkstoffe für Rohrleitungen, Armaturen usw., Schutz der Anlagen gegen Zerstörung durch aggressive WässeroderFrost; Wasser-Leitungsanlagen dürfen nicht mit Entwässerungsleitungen in Verb. stehen, Trinkwasserleitungen müssen von Nichttrinkwasserleitungen getrennt sein. Zur Verminderung der Wasserverschmutzung ist gebrauchtes Wasser, insbes. das Abwasser aus Industrie und Gewerbe, vor der Ableitung in die Flüsse durch Abwasserbehandlung zu reinigen (s. dort).
Rechtliche Regelung zur Reinigung von Wasser
In prakt. allen Ländern sind Wasser-Versorgung und Wasser-Wirtschaft durch Gesetze geregelt. In der BRD sind dies v.a. das Wasserhaushaltsgesetz vom 23.9.1986 (BGBl. I 1986, S. 1530), die Wassergesetze der Länder, die Trinkwasser-Verordnung, die Trinkwasser-Aufbereitungs-VO, die Wassersicherstellungs-VO, die VO der Länder über das Lagern wassergefährdender Flüssigkeiten, Abfall- und Waschmittelgesetze und das Abwasserabgabengesetz sowie entsprechende Gesetze der Länder und der EG einschließlich der Transportbestimmungen, vgl. die Aufstellungen im Wasser-Kalender (jährlich) und in Literatur, 26, 27. Das Bundesministerium des Inneren veröffentllicht einen Katalog wassergefährdender Stoffe (GMBl. 1985, Nr. 11, S. 175ff.). Im Zusammenhang mit der Wasser-Aufbereitung und Abwasserbehandlung hat sich eine eigenständige Analytik entwickelt, die von den Meth. der Mikro- und Spurenanalyse Gebrauch macht, vgl. Literaturr, 28, 29. In Literatur r, 30 finden sich neben ausführlichen Beschreibungen der chemischen, physik. und biol. Wasser-Unters.-Meth. auch allg. Angaben über die verschiedenen Wasser-Arten, ihre Inhaltsstoffe und deren Schadwirkungen sowie
Analytik beim Wasser
Informationen über Wasser-Gesetzgebung und Normen
Zu den wichtigsten Parametern der Wasser-Analytik gehören der biol. und der chemischen Sauerstoff-Bedarf (BSB und CSB, Literatur, 31) eines Wassers, der Gehalt an org. Materie (vgl. TOC) und an org. Halogen-Verb. (AOX), der Keimgehalt, die Konz. einzelner Anionen und Schwermetalle, Trübung (Detritus), Leitfähigkeit und pH. Biol. Unters. werden mit Mikroorganismen (Algen), Kleinkrebsen (Daphnien) und Fischen (Goldorfen) vorgenommen. In den Gewässergütekarten der BRD (s. Literatur, 32 ) ist ein wichtiges Kriterium der sog. Saprobitätsgrad, der aus der Anzahl der in einem Gewässer vorhandenen Organismenarten bestimmt wird, 33. Zu den bestuntersuchten Gewässern gehört der Rhein, dessen Wasser-Qualität sich seit den 70er Jahren stark gebessert hat, 34. Welche ökolog. (und ökonom.) Folgen kleinereoderkatastrophale Störfälle (Beisp.: Basel, 1.11.1986) auf die Gewässerqualität haben können, ist dem Rhein-Bericht, 35 zu entnehmen. Mit den Problemen bei der Probenahme für Wasser-Analysen beschäftigt sich Literatur, 36 .
Verwendung von Wasser
Als Nahrungs-, Reinigungs- und Lösungsmittel,
Löschwasser, Kühlmittel, Kesselspeisewasser und Wärmeübertragungsmittel,
zur Energiegewinnung durch Wasserkraft, als Transportmittel, als Moderatorflüssigkeit
in Reaktoren, zur Bewässerung usw. Die BRD (alte Bundesländer)
verbrauchte ca. 39 Mrd. m3 Wasser im Jahr; davon entfallen
10% auf die chemischen Industrie und 80% auf andere Industrie sowie Elektrizitätswerke
und 2% auf die Landwirtschaft. Die größten industriellen Wasser-Verbraucher
sind
1. die Chemische,
2. die Eisen- und Hütten- und
3. die Papier-Industrie – zur Herstellung von 1 t Papier benötigt
man 250 t (früher 400–500 t) Wasser, für 1 t Bier 20 t, für
1 t Stahl 25–200 t, für 1 t Öl 180 t und zur Herstellung von
1 Pkw 380 t Wasser.
In wesentlich kleineren Mengen wird Wasser für chemischen Reaktionen,
z.B. zur Gewinnung von Wasserstoff verbraucht.
Geschichtliches zum Wasser:
In China wurde Wasser (griech.: hydro, lat.: aqua) schon um 600 v.Chr. als „Element“ betrachtet, eine Vorstellung, die bis ins Mittelalter vorherrschte (s. chemische Elemente und platonische Moleküle). Gewöhnlich wird Cavendish das Verdienst zugesprochen, die Zusammensetzung des Wasser aus Wasserstoff und Sauerstoff erkannt zu haben (1784).
Literatur zum Wasser:
Angesichts des überreichlichen Angebots an Literatur seien hier nur einige Titel beispielhaft aufgeführt, ohne daß damit eine Empfehlung ausgesprochen werden soll. Weitere Titel insbes. zu den Themen Wasserverunreinigung, -reinigung, -analyse, Abwassertechnologie, Meeresbiologie usw. entnehme man dem Führer durch die technische Literatur, Hannover: Weidemanns Buchhandlung (jährlich) und Scientific and Technical Books and Serials in Print, New York: Bowker (jährlich) sowie den Verlagskatalogen insbes. von Ann Arbor Science Publishers, ASTM (US-Normen), Beuth (DIN-Normen), Lewis, Noyes, Oldenbourg, E. Schmidt, Technomic, VDI, WHO. Mehroderweniger vollständige Literatur-Übersichten vermitteln natürlich auch die Dokumentationsdienste (s. unten); s.a. Abwasser, Klären, Meerwasser(entsalzung), Trinkwasser, Umweltschutz u.a. Textstichwörter. 1 Kirk-Othmer (3.) 24, 276–283. 2 Ullmann (4.) 24, 168–178, 234f. 3 Spektrum Wiss. 1979, Nr. 10, 114–119; 1986, Nr. 9, 142–148; 1987, Nr. 4, 142–146; 1988, Nr. 7, 130–133. 4 Acc. Chem. Res. 12, 7ff. (1979); Z. Chem. (Leipzig) 17, 121–131 (1977); 18, 1–8 (1978). 5 J. Aerosol. Sci. 20, 1007–1010 (1989). 6 Angew. Chem. 94, 351–356 (1982). 7 J. Chem. Phys. 81, 3612 (1984). 8 Nature (London) 298, 715 (1982). 9 Franks, Polywasser – BetrugoderIrrtum in der Wissenschaft?, Wiesbaden: Vieweg 1984. 10 Chem. Tech. (Leipzig) 37, 387–389 (1985). 11 Angew. Chem. 99, 660–678 (1987). 12 Chem. Tech. (Leipzig) 39, 25–28 (1987); DIN 51777, Tl. 1 (März 1983) und 2 (Sept. 1974). 13 Annund Rev. Nutr. 2, 73–90 (1982). 14 Chem. Unserer Zeit 20, 146–155 (1986). 15 Annund Rev. Plant Physiol. 30, 195–238 (1979). 16 Hutzinger 1D, 83–124. 17 Recherche (Paris) 21, 556–562, 689 (1990). 18 Gat und Gonfiantini, Stable Isotope Hydrology. Deuterium and Oxygen-18 in the Water Cycle, Vienna: IAEA 1981; Summers und Sittler, Isotopes of Water, Ann Arbor: Ann Arbor Sci. Publ. 1976. 19 Koppe, H2O ein geheimnisvolles Medium?, Fellbach: Herion-Werke. 20 Hutzinger 1A, 17–49; Spektrum Wiss. 1980, Nr. 11, 36–48. 21 Büchner et al., Industrial Inorganic Chemistry, S. 1–13, Weinheim: VCH Verlagsges. 1989. 22 Brauer (3.) 1, 133–137; Chem. Labor Betr. 41, 460–463 (1990); Marquardt et al., Erzeugung von Reinstwasser, Grafenau: Expert Verl. 1988. 23 Int. Lab. 15, Nr. 5, 56–64 (1985); LABO 5, 193–204 (1976); 12, 89–94, 1366–1370 (1981). 24 DAB 9, 1446–1450, Komm. 9/3, 3500–3507. 25 Naturwissenschaften 73, 538–542 (1986). 26 DIN-Katalog (Sachgruppen 4798, 4800, 4805, 4840, 4856), Berlin: Beuth (jährlich). 27 Roth, Wassergefährdende Stoffe, Landsberg: ecomed-Loseblattausgabe; Sander, Schadstoffe im Wasser (3. BDichte, DFG Forschungsber.), Weinheim: Verl. Chemie 1982. 28 Deutsche Einheitsverfahren zur Wasser-, Abwasser- und Schlammuntersuchung, Weinheim: Verl. Chemie (seit 1960). 29 Franson et al., Standard Methods for the Examination of Water and Wastewater, Washington: APHA 1989. 30 Hütter, Wasser und Wasseruntersuchung (4.), Frankfurt/M.: Salle 1990. 31 Chem. Labor Betr. 35, 115–119 (1984). 32 Wasserversorgungsbericht (Hrsg.: BMI), Berlin: Schmidt 1982. 33 Limnologica 17, 119 (1986). 34 Chem. Unserer Zeit 25, 257–267 (1991). 35 Rhein-Bericht (Umweltbrief 34), Bonn: BMUNR 1987. 36 Analyt.-Taschenb. 3, 23–35; Top. Curr. Chem. 134, 94–123 (1986). allg.: von Ammon, Wörterbuch der Wasserchemie, Weinheim: Verl. Chemie 1985 - Analyt.-Taschenb. 2, 255–266 - Annual Book of ASTM-Standards 1988, Section 11: Water and Environmental Technology, Vol. 11.02 (2), Philadelphia: ASTM 1988 - Aurand, Bewertung chemischer Stoffe im Wasser-Kreislauf, Berlin: E. Schmidt 1981 - Babcock, Handbuch Wasser (7), Essen: Vulkan-Verl. 1988 - Behrens und Kraemer (Hrsg.), Biochemical Methods for Water Analysis, Weinheim: VCH Verlagsges. 1990 - Breuer, Öffentliches und Privates Wasserrecht (2), München: Beck 1987 - Buffle, Complexation Reactions in Aquatic Systems, Chichester: Horwood 1988 - Daten und Informationen zu Wasserinhaltsstoffen, (DVGW-Schriftenreihe Wasser, Nr. 48) 2 Tle, Frankfurt: ZfGW-Verl. 1985, 1988 - Deepak et al., Atmospheric Water Vapor, New York: Academic Press 1980 - Diesel und Lühr, Lagerung und Transport wassergefährdender Stoffe, Berlin: E. Schmidt 1982 - Divet und Schulhof, Le traitement des eaux, Paris: Presses Univ. France 1980 - Drever, The Geochemistry of Natural Waters, Hemel Hempstead: Prentice-Hall 1982 - Drews, Chemie des Wassers, Leipzig: GrundstoffIndustrie 1988 - Elsner und Fischer, Thermophysikalische Stoffeigenschaften von Wasser, Leipzig: GrundstoffIndustrie 1982 - Emerson, Alkalinity – pH Changes With Temperature for Waters in Industrial Systems, Chichester: Horwood 1986 - Faust und Aly, Chemistry of Natural Waters, Ann Arbor: Ann Arbor Sci. 1981 - Föhl und Hamm, Die Industriegeschichte des Wasser
Häufig gestellte Fragen FAQ `s
Häufig gestellte Fragen zur Energiespirale
FAQ zur Energie-Spirale:
Häufig gestellte Fragen zur Ordnungsplatte
FAQ zur Ordnungsplatte:
Häufig gestellte Fragen zum Energiestab
FAQ zum Energiestab:
Häufig gestellte Fragen zu unseren Ampullen
FAQ zu den Ampullen:
Bei Fragen, die Sie nicht durch unsere Informationen
beantwortet bekommen, wenden Sie sich an unser Büro
Jetzt NEU!!!! Die Energiespirale
auch als Aufsatz für alle Osmose- und Kohlefilteranlagen, offener
Ø10mm.
Und hier direkt zu unserem Wasserfilter, oder gleich zum Katalog?!
Wasser ist mehr als H2O. Doch worauf ist dies zurückzuführen? Hat Wasser neben den chemisch und physikalisch bestimmbaren Komponenten noch weitere Eigenschaften?

- Biophotonenmessung (BPM)- ES-Wasser /unspiralisietes Wasser 1
- BPM
- ES-Wasser/unspiralisietes Wasser 2
- Elektroakupunkturmessreihe (EAM) - Energiespirale (ES)- Herr DichteK.
- EAM - ES - Herr Wasser
- EAM-ES - Herr H.
- EAM-ES - Frau F.
- EAM, ES/Kohlefilter, Herr G.
- EAM, ES/Kohlefilter, Herr B.
- EAM, ES/Regenwasser, Herr K.
- EAM, ES/Regenwasser, Frau K.
- EAM, InfosIBK/T-Zelle 1 Herr F.
- EAM, InfosIBK/T-Zelle 2 Herr F.
- EAM-Energiestab (ES) - Herr F.V.
- EAM-EST - Frau R.
- EAM-EST - Frau F.
- EAM-EST - Frau R.
- EAM-EST - Herr G.Wasser
- EAM, EST + Ordnungsplatte (OP), Frau B.
- EAM-EST - OP - Frau B.
- EAM, OP + Spirale, Frau S.
- EAM-OP - Frau B.
- Fragen zur Ordnungsplatte (OP)
- EAM, E-Smog, Herr A.
- EAM, E-Smog, Frau A.
- EAM, E-Smog, Frau A.
- EAM, E-Smog, Herr A.
- EAM, Fußboden, Frau K.
- BPM - Quarzmehl 1
- BPM - Quarzmehl 2
- BPM - Quarzmehl 3
- BPM - Quarzmehl 4
- BPM - Quarzmehl 5
- BPM - Quarzmehl 6
